2. Introduzione Alla cromatografia
L'esigenza di separare i singoli costituenti di miscele anche molto complesse ha portato allo sviluppo, nel corso degli anni, di numerose tecniche di separazione, che vanno dalla distillazione frazionata, alla cristallizzazione, all'estrazione, alla filtrazione, e così via fino alla spettrometria di massa. In ogni caso, si tratta di individuare le differenze, anche minime, fra le varie specie chimiche e realizzare una tecnica in grado di amplificarle per ottenerne la migliore, più rapida e possibilmente più economica separazione possibile.
Nell'ambito di questo discorso, non c'è dubbio che i metodi cosiddetti Cromatografici si siano rivelati fra i più efficienti e versatili, tanto che il loro campo di applicazione si estende in tutti i rami delle scienze naturali.
La tecnica cromatografica consiste nello sfruttare, in modo particolarmente efficiente, la diversa attitudine che ogni molecola o ione possiede nel distribuirsi fra due differenti fasi. Si tratta dunque dello stesso principio su cui si basa la classica tecnica dell'estrazione, nella quale non si fa altro che trasferire certe specie chimiche in una fase diversa, ad esse più affine, separandole così da tutte le altre che invece possiedono maggiore solubilità nella fase in cui già si trovano. Il numero di estrazioni necessarie per ottenere una separazione efficiente può anche essere, tuttavia, molto elevato, con ovvi problemi di perdita di materiale e impossibilità di lavorare con microcampioni. Se però una delle fasi viene in qualche modo immobilizzata (costituendo la fase stazionaria), mentre l'altra viene fatta scorrere continuamente sulla prima, è possibile condurre il processo d’estrazione in maniera continua. Una specie chimica depositata sulla fase stazionaria e immessa nella corrente di fase mobile si distribuirà, infatti, dinamicamente tra le due fasi in misura proporzionale alla diversa affinità che possiede per loro. Prima di ogni altro discorso teorico è forse bene dare una breve illustrazione di come si può eseguire in pratica una separazione cromatografica; per questo vale la pena di riportare direttamente i passi principali dell'articolo con cui il russo Tswett annunciò, nel 1906, l'invenzione della cromatografia. Nonostante alcune sporadiche esperienze precedenti, va infatti attribuita a Tswett l'interpretazione fondamentalmente corretta del fenomeno nonché la chiara intuizione dei suoi sviluppi futuri.
"Se una soluzione di clorofille in etere di petrolio viene filtrata attraverso una colonna di materiale adsorbente (io uso di solito carbonato di calcio, impaccandolo con cura in uno stretto tubo di vetro) allora i pigmenti vengono "risolti" dall'alto al basso della colonna in varie zone colorate e secondo una certa sequenza. Infatti i pigmenti maggiormente adsorbiti spostano quelli che lo sono di meno facendoli passare oltre, lungo la colonna. La separazione diviene praticamente completa se, una volta esaurita la soluzione dei pigmenti. Si fa passare del solvente puro attraverso la colonna di adsorbimento.
Così, come i raggi di luce in uno spettro, i diversi componenti della miscela vengono risolti sulla colonna di calcio carbonato secondo una legge definita e possono essere valutati sia qualitativamente che quantitativamente.
Io chiamo questa preparazione "cromatogramma" e "metodo cromatografico" la tecnica corrispondente. È ovvio che i fenomeni di adsorbimento descritti non sono limitati ai pigmenti delle clorofille e si può ritenere che ogni genere di composti, colorati o no, siano soggetti alle medesime leggi"
2.1 CENNI GENERALI SULLA CROMATOGRAFIA
Per descrivere meglio il fenomeno della cromatografia possiamo immaginare una colonna riempita con un'opportuna fase stazionaria in testa alla quale sia già stato depositato un piccolo volume di una miscela di tre diverse specie chimiche, sciolte in un solvente adatto.
Man mano che il solvente (fase mobile) viene introdotto in testa alla colonna e fatto percolare attraverso la fase stazionaria, si nota la tendenza, da parte dei vari componenti della miscela, a correre in misura diversa a seconda della maggiore o minore affinità nei confronti delle due fasi in competizione. Continuando l'eluizione, le specie A, B e C si separano completamente e possono così venire raccolte una dopo l'altra in uscita dalla colonna.
Indipendentemente dal meccanismo effettivo della separazione, legato al tipo di interazione fra soluto e fase stazionaria, durante la cromatografia ciascuna specie chimica si trova coinvolta in un processo dinamico nel quale essa si trasferisce dalla fase mobile a quella stazionaria, e viceversa
Ogni sostanza si distribuisce così fra le due fasi in un modo che le è proprio. Indicando con CM e CS le sue concentrazioni nella fase mobile e nella fase stazionaria rispettivamente e supponendo che le condizioni sperimentali siano tali da conseguire il raggiungimento di equilibri successivi del tipo:
CM « CS
possiamo rappresentare con K la corrispondente costante di equilibrio
K=CS / CM
che, nel caso specifico, prende il nome di Coefficiente di Distribuzione K è un parametro termodinamico e da esso dipende il grado di ritenzione di una certa specie chimica nella colonna.
Infatti, il tempo che una sostanza trascorre nella colonna dipende dal valore di CS rispetto a CM: così, una elevata concentrazione nella fase stazionaria rispetto a quella nella fase mobile indica una maggiore affinità per la prima. In altre parole, l'eluente incontrerà una certa difficoltà nel trascinare con sé alcune sostanze, mentre altre, relativamente più affini ad esso e meno verso la fase fissa, verranno più facilmente dislocate dalle posizioni che occupano e trasportate così verso la coda della colonna, separandosi sempre di più dalle prime.
Si può dunque pensare ad un processo di estrazioni selettive in continuo che possono essere paragonate, sul piano teorico e pratico, al funzionamento di una colonna di distillazione a piatti. Questa analogia si è rivelata piuttosto proficua, tant'è vero che per esprimere determinate prestazioni di un dispositivo cromatografico si fa riferimento al suo contenuto in piatti teorici.
Continuando a far passare solvente e ricorrendo, se necessario, a solventi con caratteristiche diverse, è possibile far uscire dalla colonna tutte le specie chimiche che costituivano la miscela di partenza. Questa tecnica, che prende il nome di eluizione, consente la raccolta e perciò la determinazione quantitativa, nonché l’eventuale riconoscimento qualitativo, di ogni componente del campione. Registrando su un grafico la quantità (massa) di sostanza eluita rispetto al tempo trascorso in colonna o (ciò che è la stessa cosa) al volume totale di fase mobile che ha attraversato la colonna stessa, si ottengono i cosiddetti cromatogrammi riportati nella parte sperimentale di questa tesina.
Il cromatogramma può essere ricavato raccogliendo le varie frazioni (volumi) di solvente che escono dalla colonna e pesando semplicemente la massa di sostanza eluita in esse contenuta; oppure, come accade nelle tecniche interamente strumentali, si ricorre a dispositivi automatici di rivelazione (detectors) che sono in grado di comunicare in continuo la massa o la concentrazione di soluto che li sta attraversando.
2.2 NOZIONI SULLE TECNICHE CROMATOGRAFICHE
Nelle tecniche cromatografiche oggi in uso la fase stazionaria può essere un solido o un liquido. Depositati su una superficie o introdotti in una colonna. Quanto alla fase mobile, può essere un gas o un liquido a bassa viscosità che viene fatto correre attraverso una colonna, oppure (e ciò vale solo per i liquidi) salire o scendere per capillarità lungo uno strato di fase stazionaria.
A seconda dello stato fisico e della natura delle due fasi si verificano interazioni molto diverse con il campione: su queste basi si può stabilire una classificazione dei metodi cromatografici. Tenendo anche conto del metodo in cui la fase stazionaria viene collocata per condurre la separazione.
I meccanismi di separazione nella cromatografia sono notoriamente tanti e di diversa specie con le relative variazioni per analisi più specifiche. Di questi, per quanto riguarda la gascromatografia, sono importanti soprattutto tre tipi di separazione: mediante adsorbimento, ripartizione e scambio ionico. Vediamo in dettaglio.
Nel caso in cui il principio di funzionamento si basi sull’adsorbimento, la fase stazionaria è un solido sulla cui superficie si trovano dei siti attivi in grado di stabilire una serie di legami secondari (dipolo-dipolo, ponte idrogeno, Van der Waals, dipolo-dipolo indotto, ecc.) con le diverse molecole della miscela da risolvere.
A questo fenomeno si dà il nome di adsorbimento e si parla perciò di cromatografia di adsorbimento.
A seconda che la fase mobile sia un gas o un liquido si ha pertanto la Gas-Solido (GSC, gas-solid chromatography) o la Cromatografia Liquido-Solido (LSC liquid-solid chromatography).
2.3.2 RIPARTIZIONE
Il principio di ripartizione, invece, si basa sulla vera e propria solubilizzazione di vari componenti della miscela da separare in un liquido (fase stazionaria), che può essere direttamente posto su un supporto inerte o essere predisposto su granuli finemente lavorati come un sottilissimo film. Esse pertanto si ripartiscono fra le due fasi (immiscibili fra loro) ed il parametro K prende il nome di coefficiente di ripartizione.
Quando la fase mobile è un gas, si parla di Cromatografia Gas-Liquido (GLC, gas-liquid chromatography) mentre se è un liquido si ha la Cromatografia Liquido-Liquido (LLC, liquid-liquid chromatography).
Nello scambio ionico la fase stazionaria è costituita da macromolecole contenenti gruppi attivi dotati di carica elettrica (positiva o negativa) i quali sono in grado di scambiare i propri controioni (negativi o positivi, rispettivamente) con la soluzione da cui vengono lambiti. In altre parole si instaura una competizione fra gli ioni caratteristici della fase fissa (cioè i controioni) e gli ioni aventi la stessa carica e contenuti nella fase mobile.
A seconda della maggiore competitività e dunque dell'affinità verso la fase stazionaria gli ioni del campione vengono perciò selezionati durante il loro passaggio e dunque separati fra loro, La tecnica che sfrutta questo meccanismo si chiama cromatografia a scambio ionico (IEC, Ion-exchange chromatography)
2.3.4 ALTRI MECCANISMI DI SEPARAZIONE
Ovviamente coesistono molte altri meccanismi di separazione, alcuni dei quali altamente specifici; di questi ne nominiamo solo alcuni: esclusione, basato su fattori più fisici, ed affinità basato su una notevole selettività di molecole.
Nella tecnica gascromatografica detta anche cromatografia in fase gassosa (GC). La fase mobile è un gas che fluisce attraverso una colonna. in cui si trova la fase stazionaria, la quale può essere un solido granulare poroso oppure un liquido Con questa tecnica è possibile analizzare con successo campioni gassosi. liquidi o solidi.
A seconda dello stato fisico della fase stazionaria. la GC si può suddividere in cromatografia gas-solido (GSC. Gas Solid Chromato graphy) e cromatografia gas-liquido (GLC, Gas Liquid Chromatography).
I meccanismi di separazione che si sfruttano in gascromatografia sono sostanzialmente tre: adsorbimento, ripartizione ed a volte esclusione molecolare.
Preventivamente è stata scelta la GLC in base alle caratteristiche delle sostanze da analizzare, poiché dallo studio delle caratteristiche chimico-fisiche delle sostanze è emerso che è la ripartizione è il meccanismo più favorevole alla separazione.
2.4.1 DEFINIZIONE DI ALCUNI PARAMETRI CARATTERISTICI
Tra i parametri caratteristici di un’analisi gascromatografica il tempo di ritenzione (tR) è senz’altro il più utile per il riconoscimento di una determinata specie chimica. Infatti, il tempo che la sostanza trascorre in colonna dipende in modo diretto dalla sua affinità per la fase stazionaria o, più precisamente, dal coefficiente di distribuzione (adsorbimento e ripartizione) fra le due fasi. K = CS / CM
È evidente che se K è molto grande la sostanza sarà, al limite, trattenuta indefinitamente in colonna mentre nel caso contrario percorrerà la colonna insieme con il gas di trasporto (carrier).
Il tempo di ritenzione di una sostanza non trattenuta viene indicato con t0 o tM (tempo morto) perché coincide con il tempo che. in ogni caso, una qualunque specie chimica deve spendere in colonna prima di raggiungere l'uscita. In generale. una qualsiasi specie chimica impiegherà. per percorrere la colonna. un tempo tR pari a:
tR = t0 + t'R
dove t'R viene definito tempo di ritenzione corretto.
Nel nostro caso tale parametro è stato fondamentale per il riconoscimento degli esteri iniettati data la sua proporzionalità in forma logaritmica con il numero di atomi di carbonio che caratterizzano le molecole dell’estere iniettato.
La capacità da parte di una colonna di fornire picchi distanziati fra loro viene espressa dalla selettività a che è uguale al rapporto tra due tempi di ritenzione corretti delle corrispettive due sostanze in analisi. Questo è un importante parametro termodinamico, che dipende solo dalla natura delle due fasi e dalla temperatura.
Tendenzialmente alle alte temperature il campione tende a concentrarsi maggiormente nella fase mobile, perciò bisogna lavorare a temperature sufficientemente basse, tali da aumentare le interazioni fase stazionaria-soluto: in pratica è opportuno che una sostanza impieghi almeno il 50 % del proprio tempo nella fase stazionaria cosicché il tempo di ritenzione risulti almeno doppio di quello di una sostanza non trattenuta.
Per quanto riguarda l’efficienza del gascromatografo sono da considerare più fattori, che necessitano di altre definizioni basilari.
Teoria dei piatti
Molto diffusamente il sistema di separazione che si adotta in gascromatografia viene spesso paragonata alla separazione di una colonna di rettifica. Nella colonna del gascromatografo infatti sussistono una serie di equilibri - non equilibri che come nella distillazione frazionata si susseguono in certe porzioni definiti piatti. Mentre nella distillazione sono ben visibili, nelle colonne impaccate e capillari sono ideali e rappresentano la lunghezza minima in cui si riesce ad avere un certo equilibrio anche se per un brevissimo tempo.
Il numero dei piatti teorici N, è dato dalla relazione:
| N = 16 | ( | TR |
) | 2 |
W |
oppure meglio ancora dalla
| N = 5,545 | ( | TR |
) | 2 |
W½ |
Per conoscere il numero di piatti effettivi Neff si userà il tempo di ritenzione.
L'altezza equivalente al piatto teorico HETP (abbreviata con H) sarà dunque data da:
H = |
L |
e |
Heff = |
L |
N |
Neff |
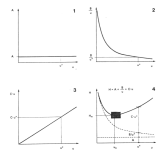
La teoria dei piatti di per sé non offre un grande aiuto all'analista perché non dà informazioni circa i fattori che determinano l'allargamento di una banda. Questa teoria in effetti ci dice solo che più lunga è una colonna. maggiore sarà il numero dei piatti teorici che la caratterizzano Sfortunatamente questa grandezza non si può usufruire molto. Praticamente si usano altre formule, spesso empiriche, che ci permettono di perfezionare i gascromagrammi, ricordiamo l’equazione di Van Deemter, le tecniche di Zuiderweg e Klinkenberg (1956) poi estese da Gluechauf e collaboratori.
La teoria delle velocità serve per conoscere la dipendenza di H dalla velocità lineare "u" del carrier in colonna, valutando l'influenza dei vari fattori accennati più sopra, ma assumendo che tali fattori non interagiscano in modo significativo l'uno con l’altro. L’equazione che meglio spiega tale dipendenza è quella di Van Deemeter, già accennata in precedenza dove
H = A + B / u + C × u
I coefficienti A, B e C sono caratteristici per una certa colonna e corrispondono alle principali cause di allargamento delle bande.
La funzione H = f(u) corrisponde ad un'iperbole asimmetrica il cui andamento è riportato in una delle figure che seguono, nelle rimanenti sono riportati graficamente i contributi dei singoli monomi della funzione.
A: diffusione microvorticosa (multipath effect, eddy diffusion)
Questa costante determina il primo effetto dell’allargamento delle bande ed è anche indipendente dal flusso del carrier (figura 1), dipende solo dal tipo di impaccamento della colonna.
B: diffusione molecolare longitudinale
Nel tratto di colonna in cui si trova la banda si generano dei gradienti di concentrazione che determinano, da parte delle molecole del soluto fenomeni di diffusione nella fase mobile, in tutte le direzioni ed in particolare, in senso longitudinale, pro e contro il movimento della fase mobile stessa: ciò provoca un allargamento della banda.
Questo problema è tipico della GC dato che nelle altre tecniche cromatografiche la diffusione delle molecole non in stato gassoso è molto più bassa (da 10-4 a 10-5 volte) rispetto a quelle gassose.
C: resistenza al trasferimento di massa
La situazione di equilibrio all’interfaccia fase mobile-fase stazionaria non viene mai rigorosamente rispettata perché, come abbiamo già descritto in precedenza, la velocità dello scambio di massa fra le due fasi non è infinita. Di fatto le sostanza sono perciò soggette ad una serie di non equilibri successivi durante tutto lo spostamento in colonna.
Altri fattori che causano l'allargamento dei picchi
L’allargamento delle bande possono dipendere anche da diversi altri fattori: dalla cattiva iniezione del campione, dalla temperatura non ideale per l’analisi, dal cattiva preparazione della colonna, dal mancato condizionamento della colonna, ecc.
Per verificare il corretto compromesso dei fattori sopra descritti, è necessario anche avere una certa conoscenza circa l’affidabilità e la correttezza del grafico finale dell’analisi. A prima vista i picchi devono essere simmetrici, simili alla curva gaussiana per le colonne impaccate e simili a sottili lame nelle colonne capillari. Possibilmente non devono uscire fuori scala, dato che, come abbiamo appurato nel corso dell’analisi sono necessarie molte più conoscenze di quelle descritte in questa tesina e nei libri che abbiamo dovuto studiare, bisogna conoscere tra le altre cose anche i tipi di integratori, alcuni dei quali devono essere impostati in particolari modi poiché in certe condizioni non danno risultati buoni e/o affidabili (vedere Capitolo 6 Elaborazione Dati)
La capacità è definita come la quantità massima di campione che è possibile iniettare in colonna senza provocare fenomeni di saturazione. Questa grandezza dipende soprattutto dal tipo e dalla quantità di fase stazionaria ed influisce in modo più o meno sensibile sui tempi di ritenzione, sull'efficienza della colonna e in particolare sulla geometria dei picchi.
In definitiva occorre mettersi nelle condizioni di iniettare la quantità minima di campione, compatibilmente con i limiti di rivelabilità del rivelatore. per ottenere la massima efficienza.
Usando colonne impaccate, si iniettano solitamente da 0,1 a pochi microlitri di campione, nel nostro caso abbiamo usato da 1 a ~2,5 ml, mentre per la colonna capillare da 0,1 – 0,5 ml.
La capacità di picchi è definita come la quantità massima di picchi che possono venire registrati in un certo intervallo di tempo con risoluzione unitaria